3. Enfermedades de transmisión sexual que se asocian con fallo reproductivo en hembras
3.1. Tricomonosis y campilobacteriosis genital bovina
Revisado en: Bondurant (2005); García-Peña (2005); Michi et al. (2016); EFSA (2017a,b(; Collantes-Fernández et al. (2018); Silveira et al. (2018) y Collantes-Fernández & Horcajo (2019).
3.1.1. Definición e importancia
La tricomonosis (TB) y campilobacteriosis genital bovina (CGB) son dos enfermedades venéreas del ganado bovino que son frecuentes en los sistemas extensivos donde se usa la monta natural. En España, los datos de prevalencia de ambas enfermedades obtenidos por el grupo SALUVET indican la presencia de estas enfermedades en los sistemas donde se utiliza la monta natural, con prevalencias individuales que pueden llegar hasta el 30%, dependiendo de la zona y de la presencia de factores de riesgo (Mendoza-Ibarra et al., 2012; 2013; Collantes-Fernández et al., 2014; 2019; Fort et al. 2016). Su diagnóstico en los sementales es de gran importancia porque cursan con fallo reproductivo temprano en la hembra y por su elevado riesgo de transmisión por vía venérea (Eaglesome, 1997).
Ambas enfermedades están incluidas en la Lista de Enfermedades de la OIE y en la Directiva Europea que regula el comercio de semen bovino (European Union, 1988; 2004). La OIE establece una serie de recomendaciones para estas enfermedades respecto al comercio de animales de cría, sementales y semen (http://www.oie.int/eng/normes/mcode/en_sommaire.htm).
Las pérdidas económicas se asocian principalmente al fallo reproductivo temprano y son debidas a las causas que se detallan en la Tabla 4.
Tabla 4. Las pérdidas económicas producidas por la TB y CGB

3.1.2. Etiología
El agente etiológico de la TB es el parásito protozoo Tritrichomonas foetus (Familia Trichomonadidae) y la bacteria Campylobacter fetus subespecie venerealis (Clase Epsilonproteobacteria, Orden Campylobacteriales) el agente etiológico de la CGB (Figura 7). Ambos patógenos se localizan en el tracto reproductor de la vaca y del toro.
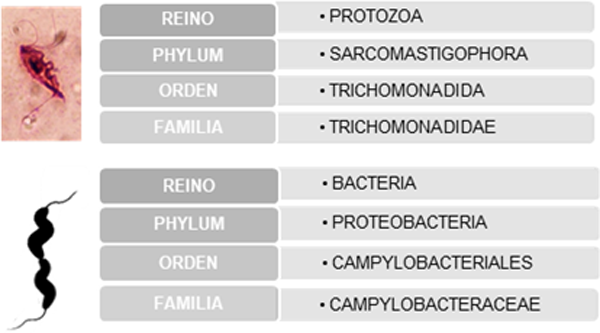
Figura 7. Clasificación taxonómica y morfología de T. foetus y C. fetus venerealis
3.1.3. Aspectos epidemiológicos
La transmisión de estos agentes se produce, casi exclusivamente, mediante la cópula (Figura 8). Ocasionalmente, si se utiliza material contaminado, pueden transmitirse de forma mecánica durante la inseminación artificial o durante la exploración vaginal.
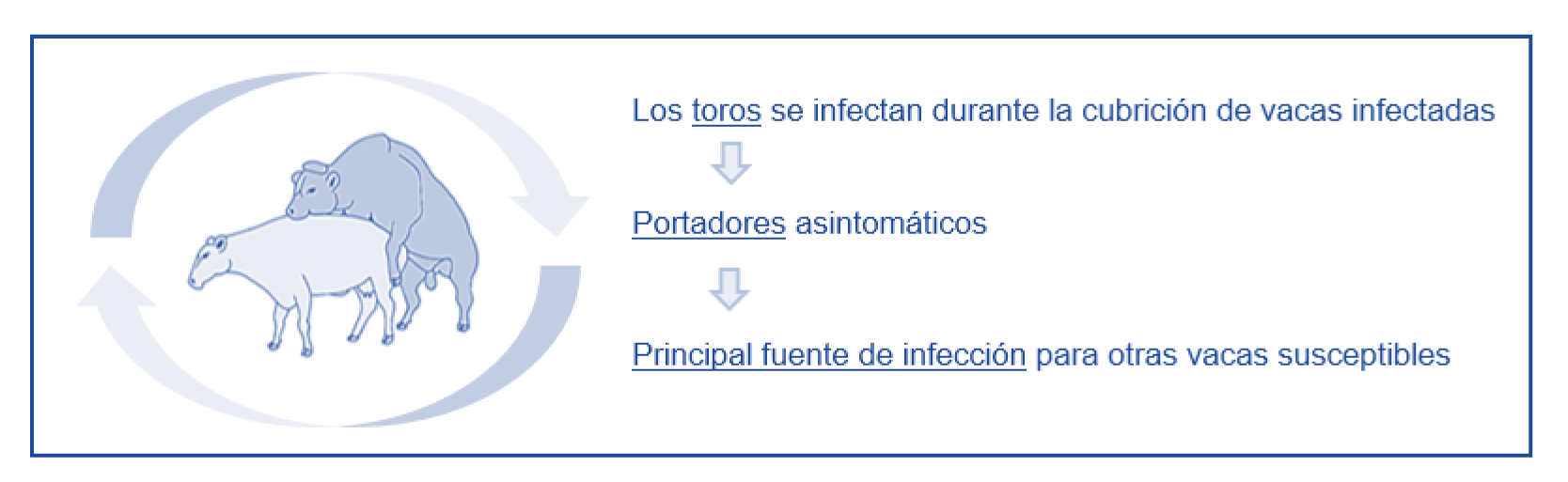
Figura 8. Transmisión de la TB y CGB
En la Tabla 5 se describen los principales factores de riesgo que contribuyen a la presentación de la TB y CGB.
Tabla 5. Factores de riesgo de la TB y CGB

3.1.4. Patogenia y signos clínicos
En el toro, el patógeno se localiza preferentemente en la parte posterior de la mucosa prepucial, y en la vaca en los pliegues del cérvix. En el toro la infección es asintomática y la fertilidad no está afectada ya que la infección no tiene carácter invasivo, no produce lesiones ni alteraciones en la calidad seminal o en la libido. Sin embargo, el toro permanece infectado de por vida. En la vaca la infección es autolimitante en la mayor parte de los casos y se elimina aproximadamente a los 4 meses. El embrión o el feto se pierden casi siempre en el primer tercio de la gestación como consecuencia de la inflamación del útero. La manifestación clínica es el fallo reproductivo temprano. Los signos clínicos a nivel individual y de rebaño se resumen en la Figura 9.
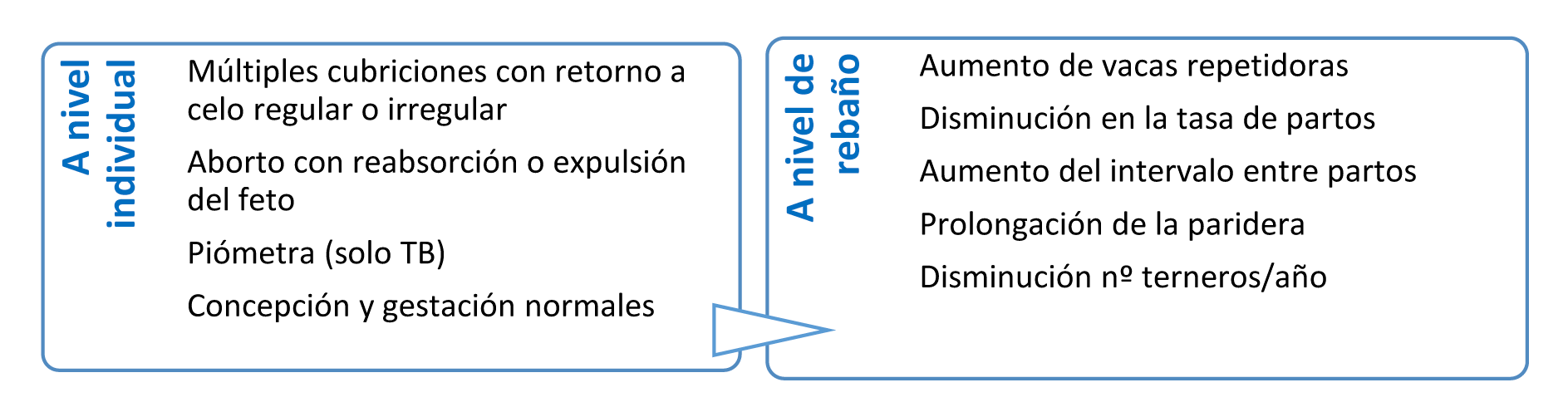
Figura 9. Signos clínicos a nivel individual y de rebaño TB y CGB
3.1.5. Diagnóstico de laboratorio
El diagnóstico de la TB y CGB debe hacerse de forma conjunta en el semental, especialmente en zonas de ganadería extensiva donde se use la monta natural. Para el diagnóstico de la infección en un rebaño, lo recomendable es muestrear a los sementales en vez de a las hembras, debido a la persistencia de la infección en el toro.
La toma de muestras, el transporte y la detección del agente en el laboratorio, son puntos clave que deben llevarse a cabo siguiendo procedimientos normalizados y validados.
Recogida de muestras en el toro
La toma de muestras en el toro es un punto clave (Tabla 6), ya que de ella dependerá la fiabilidad de los resultados. La muestra de elección en el toro es el esmegma prepucial obtenido mediante un raspado prepucial con raspador (Figura 10). Los raspadores son instrumentos metálicos o plásticos de 70 cm de largo que tienen un extremo anterior ranurado de aproximadamente 10 cm de largo y 8 mm de diámetro, por medio del cual se facilita la acción del raspado de los pliegues prepuciales. Muchos autores han avalado su empleo por la rapidez con la que se opera y por la sencillez del método. Además, disminuye la contaminación por orina y no se necesita de un asistente para la toma de la muestra. Siempre se debe esterilizar el raspador antes de muestrear un animal o emplearse raspadores de un solo uso.
Tabla 6. Puntos clave en la toma de muestras en el toro para el diagnóstico de la TB y CGB

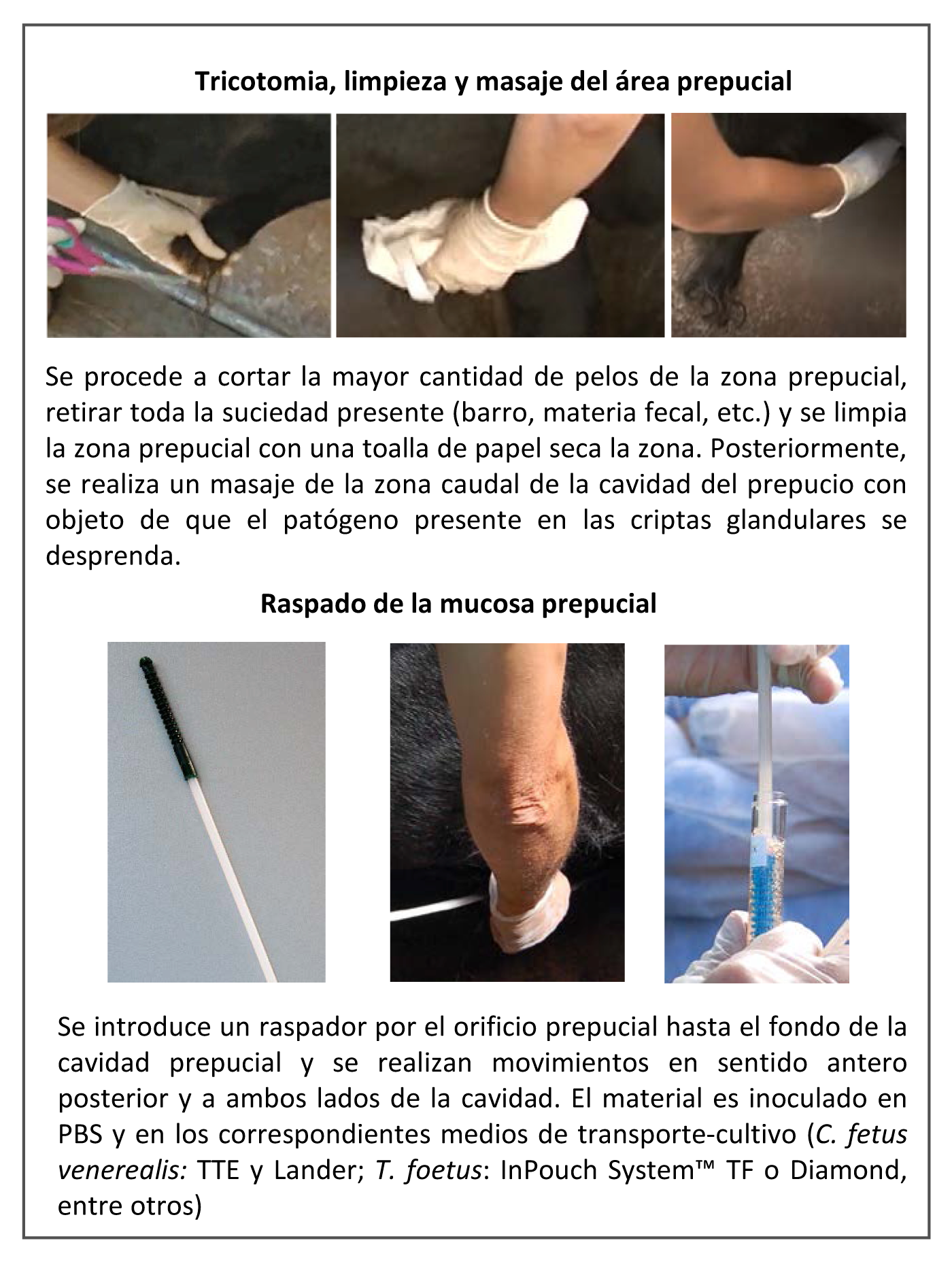
Figura 10. Procedimiento para la toma de una muestra de esmegma prepucial para el diagnóstico de la TB y CGB (Collantes-Fernández & Horcajo, 2019)
Recogida de muestras en la hembra, feto y placenta
Aunque el diagnóstico debe realizarse siempre en el macho, también es posible la detección de los patógenos en las hembras sospechosas o que han presentado signos clínicos. Se aconseja realizar el muestreo lo antes posible después de la cubrición de un toro positivo o sospechoso, o tras la detección de los primeros signos clínicos como piómetra y repeticiones de celo. Si el muestreo se realiza varios meses de finalizado el servicio, el valor de una muestra negativa es muy limitado debido al carácter autolimitante de la infección en la hembra, por lo que el diagnóstico es menos exitoso que en el macho. La presencia de vacas positivas tiene valor desde el punto de vista de un rebaño infectado y no como diagnóstico individual.
La muestra de elección en la hembra es el moco cérvico-vaginal que se recoge por medio de una pipeta de inseminación artificial o bien mediante la vaina de Cassou, muestreando el área cérvico-vaginal. En el caso de una piómetra se puede aspirar el contenido. El material recogido se inocula directamente en los medios de trasporte-cultivo específicos para cada patógeno y en PBS para PCR. El método de muestreo se describe a continuación:

Los fetos abortados no son muestras habituales en el diagnóstico. De ser factible, se podrá enviar un trozo de placenta abarcando 3 ó 4 cotiledones, pulmones, hígado y el fluido de abomaso y proventrículos.
Técnicas de diagnóstico
Las técnicas que se utilizan para el diagnóstico de la TB son:
– Cultivo in vitro e identificación microscópica del parásito en los medios de transporte-cultivo (InPouch o Diamond). La sensibilidad del cultivo depende en gran medida de la calidad de la muestra y del medio de cultivo, así como de las condiciones del transporte. Las ventajas de esta técnica son la sencillez de realización en los laboratorios de diagnóstico y su bajo coste. Sin embargo, no permite la discriminación de T. foetus de otros protozoos tricomonádidos intestinales y coprofílicos (Sager et al., 2007).
– PCR a partir de la muestra de esmegma prepucial introducida en el tubo de PBS o en el de transporte-cultivo. El uso de la PCR en el diagnóstico de la TB es fundamental ya que detecta un bajo número de parásitos (incluso muertos), permite su detección en muestras con contaminación bacteriana y la identificación precisa de los animales infectados al diferenciar T. foetus de otros protozoos tricomonádidos intestinales y coprofílicos que pueden crecer en los medios de cultivo (Felleisen et al., 1998).
Se recomienda el uso combinado de ambas técnicas para aumentar la sensibilidad y la especificidad en el diagnóstico de la TB si no se hacen remuestreos. En el caso de resultados discordantes o no concluyentes, se recomienda muestrear de nuevo al animal.
Las técnicas que se utilizan de rutina para el diagnóstico de la CGB son:
– Cultivo de C. fetus venerealis, pruebas de crecimiento y bioquímicas. Se realiza sembrando la muestra de esmegma prepucial en el medio de transporte (Lander o TTE). La confirmación del aislamiento y la distinción entre las subespecies de C. fetus debe llevarse a cabo mediante pruebas de crecimiento y bioquímicas (Tabla 7).
Tabla 7. Características diferenciales de varias especies de Campylobacter que pueden aislarse del tracto genital bovino y de los fetos abortados (OIE, 2017).
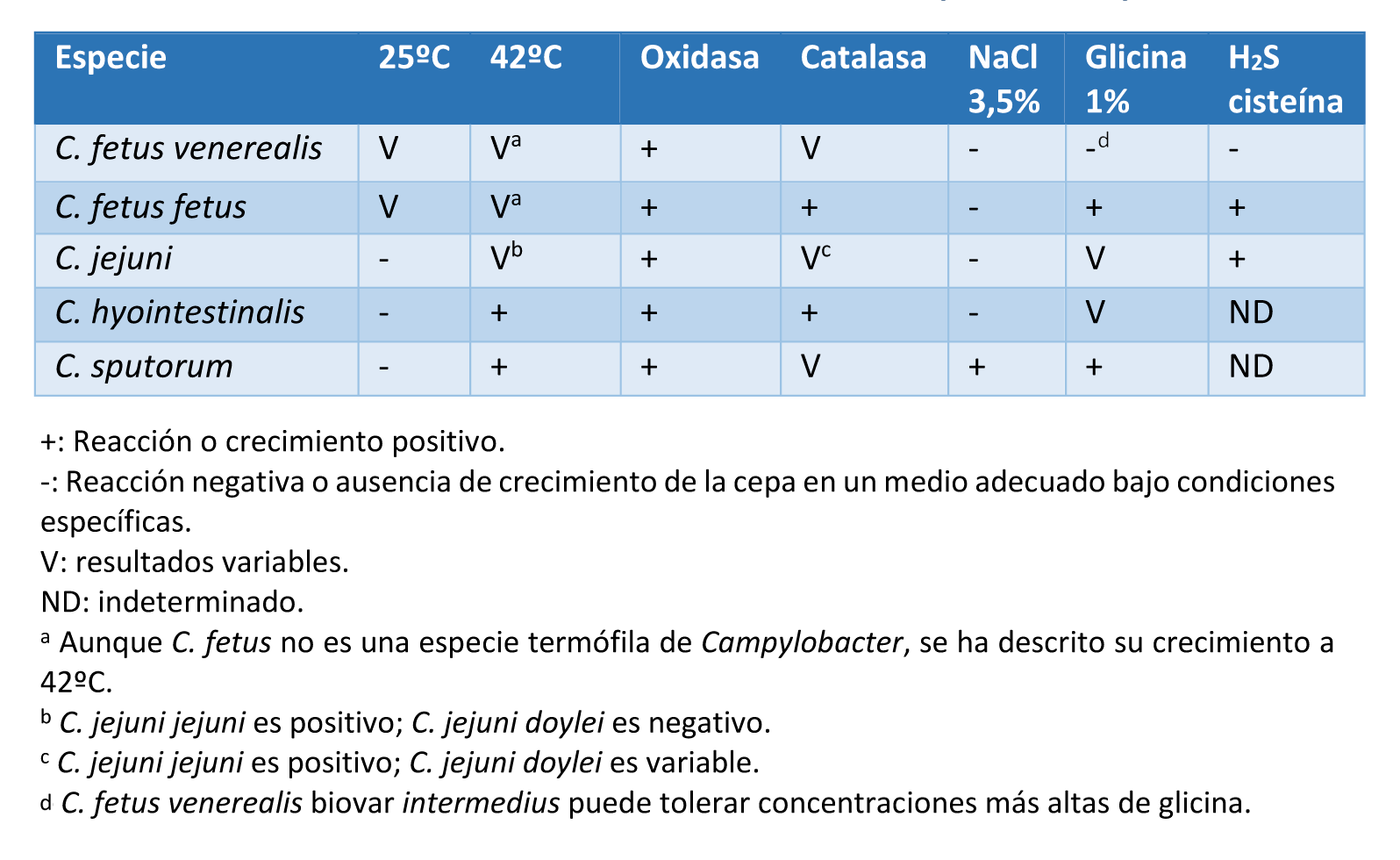
La correcta identificación de C. fetus venerealis es indispensable ya que otras especies de Campylobacter, por su localización (C. sputorum) o por contaminación con heces (C. fetus fetus, C. jejuni o C. hyointestinalis), pueden estar presentes en la muestra de esmegma prepucial utilizada para el diagnóstico. Aunque esta técnica de diagnóstico ofrece algunas ventajas, como su disponibilidad en los laboratorios, la capacidad de permitir la diferenciación de subespecies de Campylobacter spp. y la posibilidad de realizar estudios de resistencia a antibióticos, presenta también numerosos inconvenientes. El cultivo tiene baja sensibilidad debido a la escasa viabilidad del patógeno fuera del hospedador. Esta escasa viabilidad puede estar propiciada por la presencia de algunos antibióticos presentes en el medio de transporte, y por la gran sensibilidad de C. fetus venerealis a las oscilaciones de temperatura desde el muestreo hasta su llegada al laboratorio, especialmente, cuando transcurren más de 24 horas. Además, hay que considerar que esta bacteria presenta un crecimiento lento e insidioso, y puede haber crecimiento y competición de otras bacterias presentes en el prepucio. Dentro de la propia subespecie encontramos además una gran variabilidad. Existe además, una cepa intermedia, C. fetus venerealis biotipo biovar intermedius que ha demostrado tener cierta tolerancia a concentraciones del 1% de glicina y cuya significación clínica aún se desconoce. Estos inconvenientes hacen que el cultivo bacteriológico no sea la técnica de elección para el diagnóstico rutinario de la CGB (Fort et al., 2016).
– PCR: es la técnica que más se utiliza de rutina en los laboratorios de diagnóstico. Existen diferentes técnicas de PCR, siendo las basadas en el gen nanE las que han mostrado una mayor sensibilidad y especificidad (Abril et al. 2007; van der Graaf-van Bloois et al., 2013). Sin embargo, actualmente no se dispone de ninguna PCR que permita identificar con fiabilidad las cepas de C. fetus a nivel de subespecie. En este sentido, se han señalado inconsistencias en el diagnóstico de la CGB, detectando por PCR C. fetus venerealis en toros de explotaciones sin problemas reproductivos aparentes o en toros vírgenes, lo que cuestiona la especificidad de la PCR, la cual se ha visto que, además, podría variar dependiendo de los aislados de la zona geográfica que se estudie (Sanhueza et al., 2014). Estudios previos realizados en el grupo SALUVET han observado también problemas de especificidad al aplicar estas técnicas de PCR en muestras de campo de nuestro país (Fort et al., 2016).
Debido a las inconsistencias encontradas en el diagnóstico de la CGB hay que proceder con precaución al emitir un diagnóstico positivo. Desde el punto de vista práctico se recomienda el uso de técnicas de PCR perfectamente validadas en relación a su especificidad y un resultado positivo debe asociarse con un empeoramiento de los parámetros reproductivos.
3.1.6. Control
Tratamiento
En la actualidad no hay agentes terapéuticos eficaces aprobados frente a la TB.
En C. fetus venerealis, se han obtenido buenos resultados con oxitetraciclina L.A. (0,10 ml/kg), a dos dosis con un intervalo entre ambas de 72 horas, combinado con tetraciclina común, vía intraprepucial (50 ml; Campero et al., 1993; Fort et al., 2016). Se deben realizar los controles de eficacia a posteriori, a partir de 25-30 días post-tratamiento y siempre volver a analizar estos animales. El tratamiento es de especial interés en casos en los que el toro tiene un elevado valor económico, en toros jóvenes o si existe un gran número de toros infectados en el rebaño.
Vacunación
Para la TB y CGB, existen vacunas inactivadas comercializadas en Estados Unidos y Sudamérica de forma monovalente (Trich Guard®) o polivalente combinada con C. fetus venerealis y Leptospira (Trich Guard V5-L®). Además, en Argentina, se encuentra disponible una vacuna oleosa inactivada (Tricovac, Laboratorio Biológico Tandil). Sin embargo, en Europa estas vacunas no están registradas y solo está permitido su uso previa autorización por la Agencia del Medicamento. También existe la posibilidad de la utilización de autovacunas, pero su eficacia no se conoce, ya que dependerá del adyuvante utilizado y la composición antigénica. Actualmente, el grupo SALUVET está trabajando en una vacuna frente la TB con resultados prometedores. La vacunación frente a la TB es altamente recomendable en rebaños que comparten pastos, que tienen toros mayores de 3 años, no realizan un análisis periódico de los machos o tienen un alto número de toros infectados. La vacunación es eficaz en las hembras pero no en el toro, y aunque no previene la infección, reduce la gravedad y su duración, permitiendo la desaparición de la infección en hembras vacunadas antes de que sea un riesgo para el feto. De este modo, el principal objetivo de las vacunas frente a la TB es evitar la cervicitis, endometritis y placentitis, las cuales ocasionan infertilidad y pérdida de gestación.
Medidas de manejo del rebaño
La práctica de la inseminación artificial es una medida muy útil para reducir y eliminar la infección. Sin embargo, en los rebaños donde no sea posible, se recomienda la realización de análisis periódicos en los machos y las siguientes medidas (Rae & Crews, 2006; Figura 11):
Medidas preventivas
En aquellas explotaciones no infectadas con factores de riesgo se recomienda tomar las siguientes medidas preventivas para impedir la entrada de estas enfermedades:
– Control del movimiento de los animales, tanto machos como hembras. Este control incluye mantener las cercas en buen estado.
– Evitar pastos comunales. Si no es posible y los toros aprovechan estos pastos junto con las vacas, se recomienda que todos los toros que utilicen los pastos sean negativos a estas enfermedades y repetir el diagnóstico al finalizar su aprovechamiento.
– Llevar a los pastos comunales únicamente vacas y novillas preñadas, medida que se puede facilitar mediante una adecuada programación de la paridera.
– Usar sólo toros o novillas vírgenes como reposición o, en su defecto, toros jóvenes tras comprobar su procedencia y estado sanitario.
– Mantener la edad media de los toros de rebaño tan joven como sea posible.
– Diagnóstico y cuarentena de los toros adquiridos. Se recomienda el análisis de dos muestras de esmegma prepucial con dos semanas de intervalo si el toro procede de una explotación negativa y de, al menos tres, si procede de un rebaño con antecedentes.
– No mezclar las vacas o novillas de estado sanitario desconocido durante la temporada de cubrición.
Medidas de control
Cuando estas infecciones han sido diagnosticadas en un rebaño, además de las medidas preventivas expuestas anteriormente, se aconseja adoptar las siguientes medidas de control para reducir su impacto y para lograr su erradicación:
– Diagnóstico y sacrificio de los toros infectados o tratamiento, si está presente la CGB, siendo importante verificar la eficacia del tratamiento.
– Uso de inseminación artificial hasta que se controle el problema.
– Evitar la rotación de los toros entre lotes.
– Reducir el periodo de cubrición para acortar el periodo de transmisión de la infección. Además, una larga temporada de cubrición puede enmascarar la baja fertilidad atribuible a estas infecciones. Si es necesario alargar la temporada de cubrición es porque hay un problema de fertilidad y acortar el periodo de cubrición es una forma de detectarla.
– Se recomienda la separación del rebaño de dos grupos en función del riesgo de estar infectados. El grupo de bajo riesgo estaría formado por las hembras vírgenes, vacas que no han estado en contacto con toros positivos o sospechosos, vacas con más de cinco meses de gestación o vacas paridas. Éstas deben de ser cubiertas por toros vírgenes o no infectados. El resto de reproductoras (vacas expuestas a toros infectados, vacas preñadas de < 5 meses, vacas no gestantes, con o sin piómetra o vacas abortadas) sería el grupo de riesgo. Estos animales pasan al grupo de animales de bajo riesgo, una vez hayan eliminado la infección, considerándose una buena medida el dejar transcurrir 90-100 días después de la cubrición o, si están preñadas, superar los 5 meses de gestación. Además, se deben eliminar aquellas vacas que no quedan preñadas durante mucho tiempo y las que abortan de manera repetida, ya que podrían ser portadoras de la enfermedad.
– Realizar un diagnóstico temprano de gestación (35 – 60 días) para detectar pérdidas reproductivas tempranas. Aquellas vacas con diagnóstico de gestación negativo formarán parte del grupo de alto riesgo.
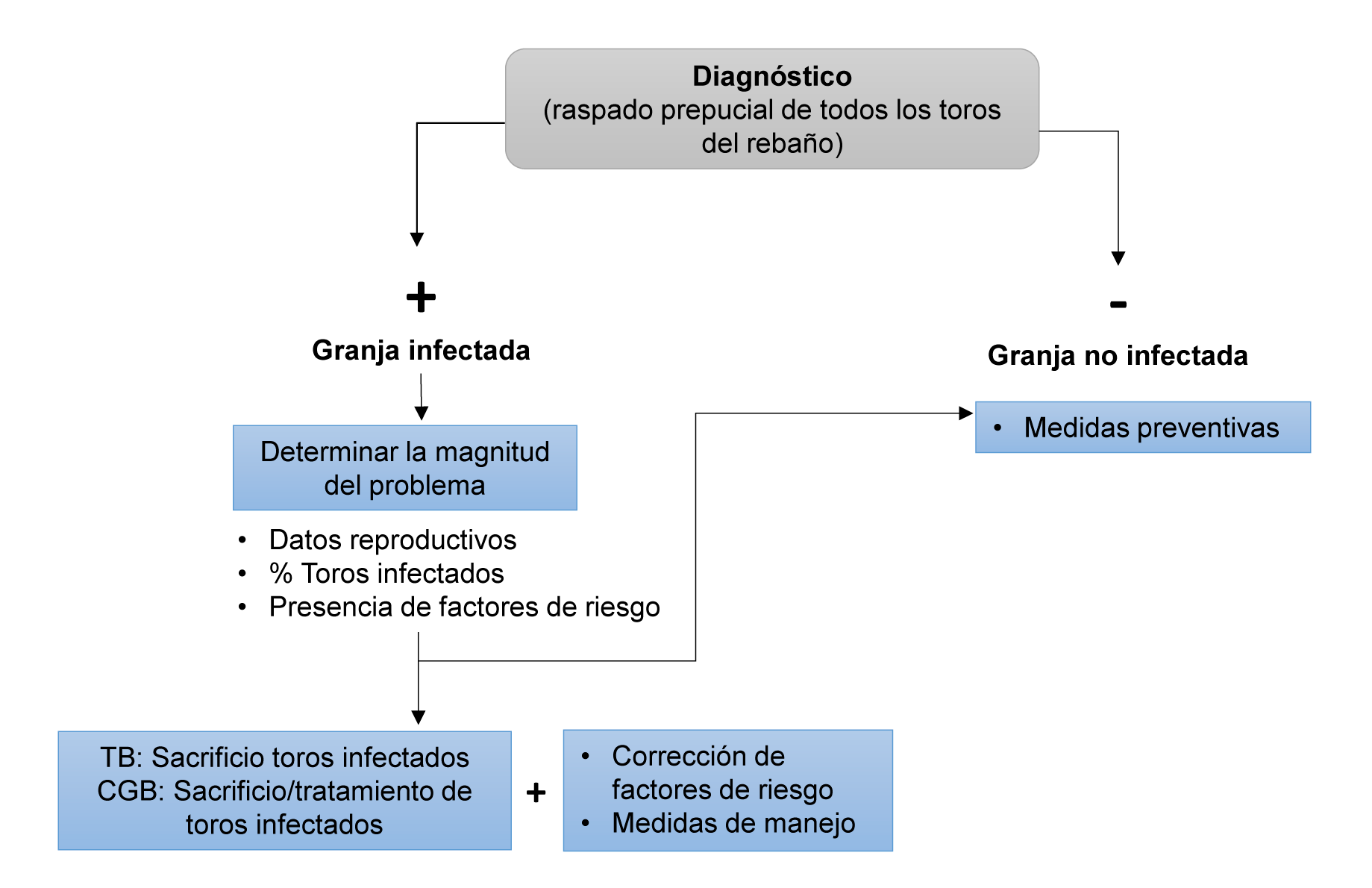
Figura 11. Principales medidas de prevención y control de la tricomonosis y campilobacteriosis genital (Collantes-Fernández & Horcajo, 2019)
3.2. DIARREA VÍRICA BOVINA
Revisado en: Kirkland et al. (1991); Houe (1999; 2006); Brodersen (2014); Lanyon et al. (2014); Evans et al. (2018); Givens (2018).
3.2.1. Definición e importancia
La BVD es una enfermedad de gran importancia en el ganado bovino que cursa con diferentes formas clínicas. En el semental la infección ocasiona alteraciones en la calidad del semen, se transmite a las hembras a través de la cubrición, y puede ocasionar fallo reproductivo y mortalidad neonatal. La BVD está incluida en la Lista de Enfermedades de la OIE y en la Directiva Europea que regula el comercio de semen bovino (European Union, 1988; 2004). La OIE establece una serie de recomendaciones para esta enfermedad respecto al comercio de animales de cría, sementales y semen (http://www.oie.int/eng/normes/mcode/en_sommaire.htm).
En España, no hay muchos estudios publicados sobre la prevalencia de la BVD en las diferentes comunidades autónomas. Es necesaria la realización de estudios nacionales que permitan conocer la situación real de la enfermedad, haciendo referencia a la presencia de animales con infección persistente como principales causantes de la diseminación de la enfermedad. En nuestro país los diferentes estudios señalan que la BVD es una enfermedad endémica ampliamente distribuida, describiéndose datos que avalan la presencia del virus en el más del 80% de los rebaños y en más del 50% de los animales muestreados (San Miguel et al., 2008). Concretamente en el ganado lechero estos valores pueden superar el 70% de prevalencia de rebaño (Mainar-Jaime et al., 2001; Vega et al., 2004; Eiras, 2010) y llegar al 100% en ganado en extensivo (Gómez-Pacheco et al., 2006; Eiras 2010) en diferentes zonas geográficas de nuestro país. Asimismo, en un estudio reciente donde se muestrearon rebaños con signos clínicos compatibles con la enfermedad, se detectó el virus en más del 30% de los rebaños (Astiz et al., 2016).
Las pérdidas económicas se asocian, en el vacuno de leche, con problemas reproductivos y mastitis, con un coste entre 21 y 135 euros por vaca tras la aparición de un brote (Lindberg et al., 2006). En el vacuno de carne la enfermedad se asocia con problemas sanitarios en terneros y recría, con diarreas y neumonías en cebaderos. En vacas nodrizas se ha estimado unas pérdidas de 58 euros por año y vaca. Si ocurre un brote las pérdidas pueden ascender a 314 euros por vaca durante algunos meses y hasta 96 euros por vaca durante un año (Gunn et al., 2004). Por otra parte, es también una enfermedad importante desde el punto de vista de exportación de animales a terceros países, ya que puede suponer una frontera para la comercialización de animales vivos.
3.2.2. Etiología
El virus de la diarrea viral bovina es un Pestivirus de la familia Flaviviridae. Existen dos genotipos antigénicamente distintos, los tipos 1 y 2. Generalmente, el virus tipo 1 es el más común y el tipo 2 se ha asociado con brotes graves. Ambos genotipos pueden darse en las formas citopática (CP) y no citopática (NCP), clasificadas en función de si produce o no cambios visibles en los cultivos celulares. Generalmente, el que circula en las poblaciones de ganado bovino es el biotipo NCP.
3.2.3. Aspectos epidemiológicos
Las fuentes de infección en un rebaño se resumen en la Tabla 8, siendo el contacto directo con animales persistentemente infectados (PI) el principal modo y el más eficiente de transmisión en condiciones naturales, ya que estos animales eliminan altas cantidades de virus y además el contacto del virus con los animales gestantes, hacen que nazcan más animales PI. Los animales con una infección aguda o transitoria pueden ser otra fuente de contagio, pero su papel epidemiológico es menos importante ya que solo pueden transmitir el virus durante las primeras semanas después de la infección (ver apartado de patogenia).
Por su parte, el toro también desempeña un importante papel en la epidemiología de la enfermedad, ya que puede eliminar el virus en el semen en tres situaciones diferentes (Givens, 2018):
Toros PI: la presencia del virus es constante en sus genitales y elimina grandes cantidades del virus en el semen durante toda su vida.
Toros con infecciones testiculares persistentes: pueden eliminar el virus a través del semen durante periodos de tiempo prolongados, aunque la cantidad de virus que eliminan en semen es menor que en los toros PI. Se cree que no es muy frecuente.
Toros con infección transitoria: durante la infección aguda el virus se eliminará en el semen durante 15-20 días de media. La infección aguda de un toro por lo general no tiene mayores consecuencias para la tasa de preñez del rebaño ya que el título viral en el semen es bajo y de corta duración (Kirkland et al., 1991).
Tabla 8. Fuentes de infección del virus BVD en un rebaño

3.2.4. Patogenia y signos clínicos
Cuando un animal no gestante se infecta, se produce una fase aguda, con una duración media aproximada de 15 días (infección transitoria), en la cual el animal es capaz de transmitir el virus. En esta fase, el virus produce una inmunosupresión transitoria en el animal que predispone a otras enfermedades (Figura 12). Posteriormente, el animal a las dos o tres semanas desarrolla anticuerpos y una respuesta celular, produciéndose la neutralización del virus y la protección del animal.
Si el animal está gestante, las consecuencias de la infección variarán en función del periodo de gestación en que se encuentre (Figura 12), destacando el nacimiento de un animal PI cuando la infección del feto se produce antes de que su sistema inmunitario esté desarrollado (entre los 30-120 días de gestación). Los animales PI, no desarrollan anticuerpos neutralizantes frente al virus, presentan grandes cantidades de virus en todos sus tejidos y son capaces de eliminarlos de por vida a través de secreciones y fluidos. Además, si estos animales llegan a su vida adulta y se usan como reproductores, en el caso de las hembras, tendrán descendencia PI. Desde el día 120-150 hasta los 180-200 de gestación, pueden aparecer efectos teratogénicos en el feto como atrofia cerebelar, degeneración ocular o braquignataia, entre otros (Lanyon et al., 2014). Tras los 160 días de gestación la infección fetal puede dar lugar a aborto o al nacimiento de terneros normales con anticuerpos.
En el macho (Figura 12), durante la infección transitoria, el virus puede multiplicarse en la próstata, vesículas seminales y epidídimo, pudiendo disminuir la calidad del semen (reducción de la densidad, la motilidad y aumento de anormalidades espermáticas) y su fertilidad. En esta fase, el virus se elimina por el semen durante un periodo de 15-20 días hasta que desarrollan anticuerpos (Kirkland et al., 1991). Además, se ha detectado antígeno del virus en células de Sertoli, espermatogonias y células epiteliales de la uretra (Borel et al., 2007; Newcomer et al., 2014). Las alteraciones en el semen desaparecen a los dos meses después de la infección. Sin embargo, los machos que nacen PI eliminarán el virus a través del semen durante toda su vida. También existen sementales con infección testicular persistente, aunque no son casos frecuentes. En estos animales, aunque seropositivos, el virus se replica en órganos inmunológicamente privilegiados como el aparato reproductor masculino y lo eliminan a través del semen durante periodos de tiempo prolongados, aunque en menor cantidad que los animales PI.
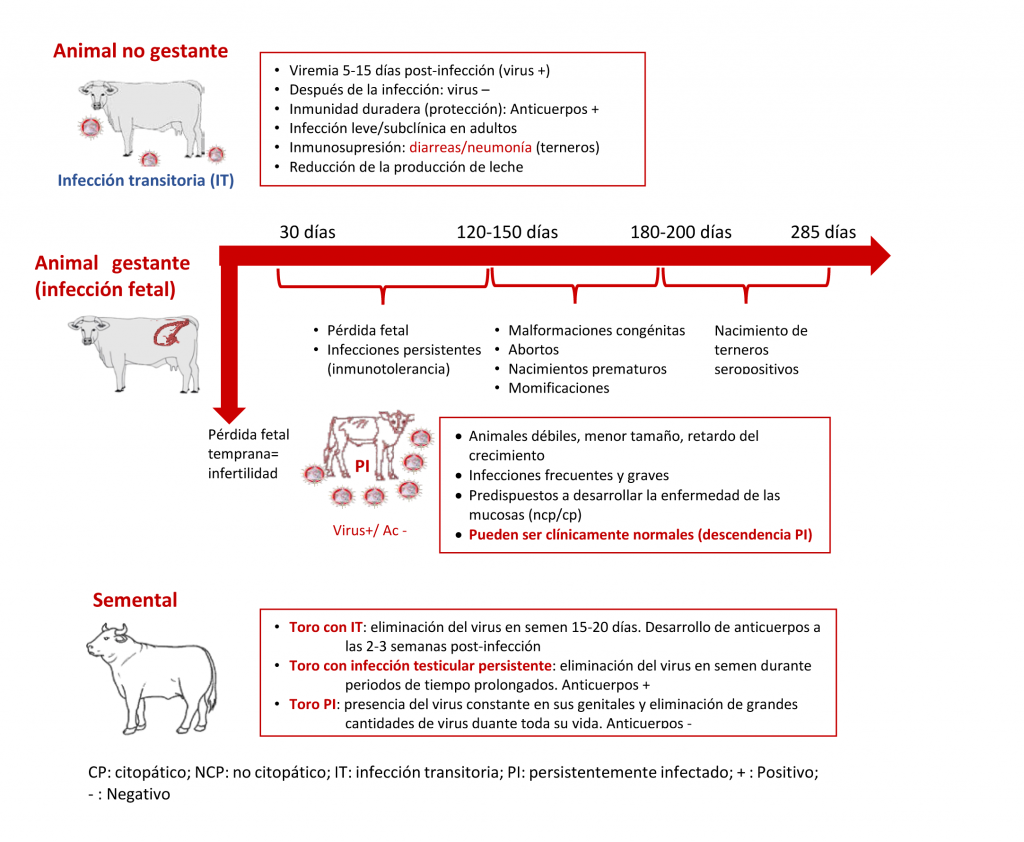
Figura 12. Patogenia y cuadro clínico de la BVD en animales no gestantes, gestantes y sementales
La BVD se presenta bajo muchas formas clínicas, que pueden ir, desde un cuadro subclínico en el que no se aprecian signos clínicos, hasta formas clínicas que cursan con diarrea o signos respiratorios que pueden agravarse hasta provocar la muerte del animal (Diéguez et al., 2009). Los signos clínicos que más se asocian a la enfermedad son diarrea, infertilidad y abortos, aunque hay otros como malformaciones, signos respiratorios, muertes embrionarias tempranas y disminución de la producción de leche (Donate, 2014). Los animales PI generalmente presentan una mortalidad muy elevada (cercana al 50% el primer año de vida), dada su alta predisposición a padecer infecciones secundarias y a desarrollar la enfermedad de las mucosas. Esta enfermedad afecta solamente a los animales PI que sufren una infección, poco después del nacimiento, por un biotipo CP homólogo antigénicamente al biotipo NCP que produjo la inmunotolerancia.
3.2.5. Diagnóstico de laboratorio
Las técnicas de diagnóstico van destinadas a la detección del virus, antígenos virales o a la detección de anticuerpos. El diagnóstico de la infección en el toro debe ir encaminado a la identificación de animales con infecciones testiculares persistentes y PI, los cuales al diseminar el virus y además, producir semen de baja calidad, serían valorados como no aptos para su uso como reproductores. Para detectar los toros con infecciones testiculares y PI, y diferenciarlos de aquellos con una infección aguda o transitoria, se deben combinar los resultados, tanto de la detección del virus o antígeno, como de anticuerpos frente al virus. Además, se recomienda remuestrear (a los 21-45 días) a los animales positivos para confirmar la presencia del virus en semen o en sangre (Tabla 9).
Tabla 9. Detección de virus y anticuerpos en animales con infecciones testiculares y PI

Recogida de muestras
Se recogerá una muestra de sangre en un tubo sin anticoagulante para la determinación de anticuerpos en suero y con anticoagulante (EDTA) para la detección del antígeno o ARN del virus. Para detectar la presencia del virus en el semen se tomará una muestra del eyaculado. Todas estas muestras se enviarán perfectamente identificadas al laboratorio en refrigeración.
Técnicas de laboratorio
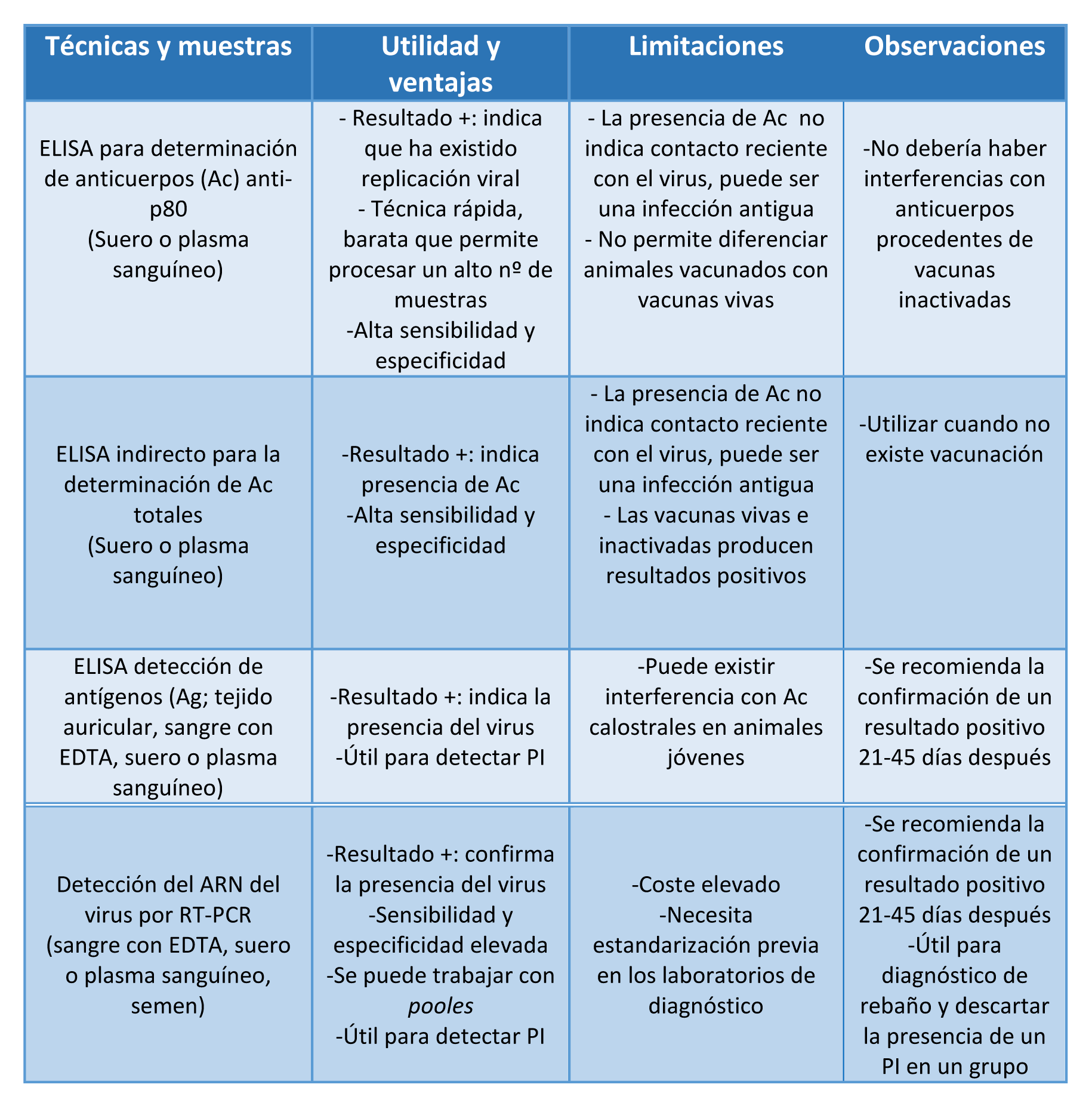
Actualmente hay una gran variedad de técnicas de laboratorio disponibles para la detección de anticuerpos por ELISA (ELISA p80 o ELISA anticuerpos totales), para la detección de antígeno viral por ELISA o del ARN por RT-PCR. Las principales utilidades, ventajas, limitaciones, así como la interpretación de los resultados obtenidos por estas técnicas se resumen en la Tabla 10.
Tabla 10. Principales técnicas de laboratorio disponibles para el diagnóstico de la BVD.
3.2.6. Control
Para el control de la enfermedad en un rebaño, lo más efectivo es la identificación y eliminación de los animales PI, la vacunación de las vacas para proteger a las preñadas y el cumplimiento estricto de las medidas de bioseguridad (Figura 13). Las vacunas (muertas o vivas) se utilizan como un medio para proteger a los animales susceptibles de infecciones transitorias, para proteger al feto de la infección y para prevenir el desarrollo de animales PI. Sin embargo, hay que tener en cuenta que no todas las vacunas tienen una protección fetal del 100%. Para que la vacunación sea efectiva, los animales PI deben ser eliminados y se deben tomar rigurosas medidas de seguridad para evitar el riesgo de introducción del virus en el rebaño. Algunas comunidades autónomas han incluido el control de esta enfermedad en los programas sanitarios llevados a cabo por las agrupaciones de defensa sanitaria ganaderas de vacuno. Estas medidas varían en función de la situación epidemiológica de la explotación. En relación al semental es importante descartar siempre a los toros PI y con infecciones testiculares persistentes. Asimismo, el semental debe seguir el programa de control que se tenga establecido en la explotación.
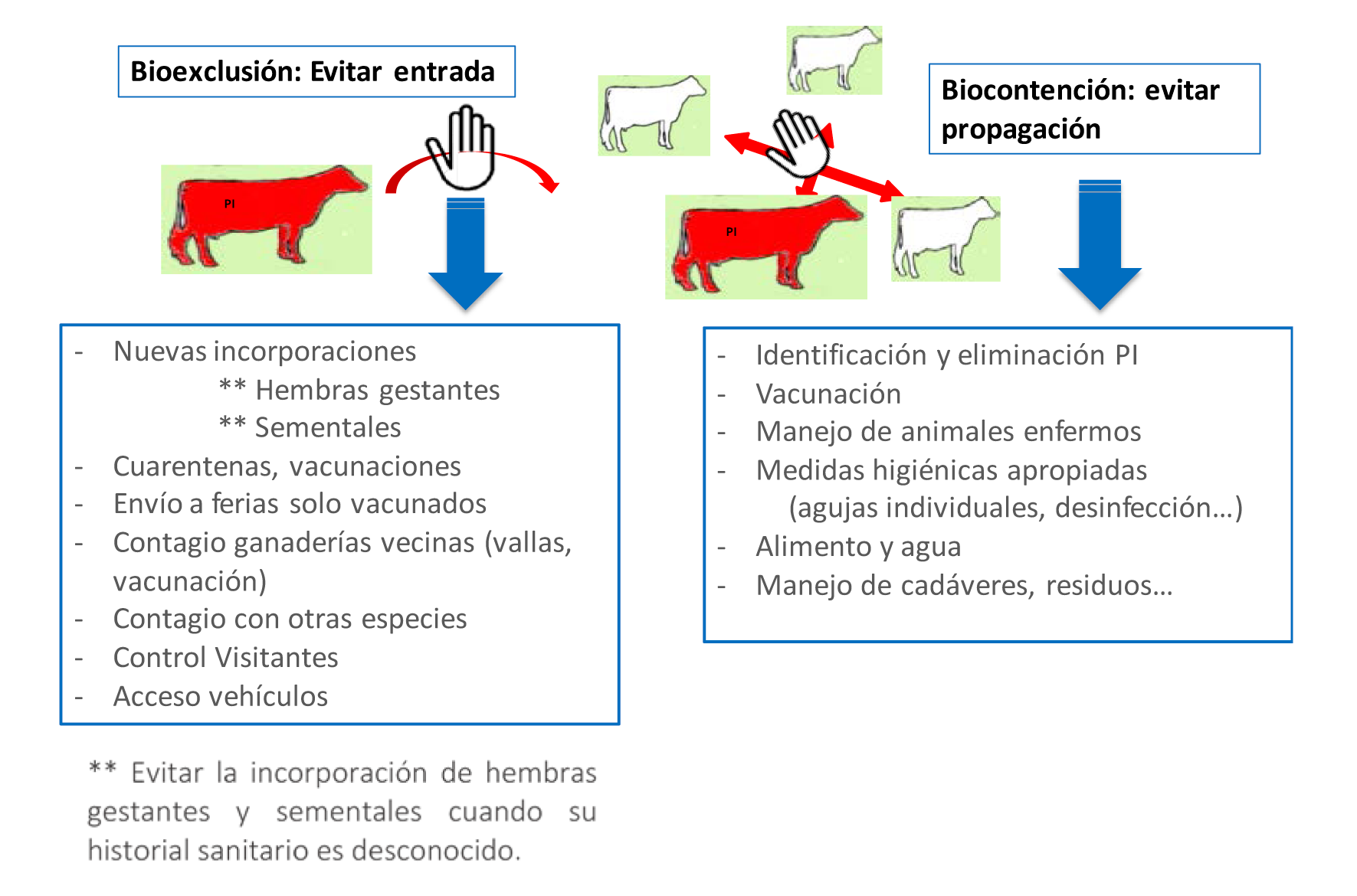
Figura 13. Medidas de bioseguridad para evitar la entrada y propagación de la infección por el virus BVD
3.3. Rinotraqueítis infecciosa bovina
Revisado en: Kahrs et al. (1977); Jones (2003); Raaperi et al. (2014).
3.3.1. Definición e importancia
La IBR es una enfermedad vírica del ganado vacuno caracterizada por producir distintos cuadros clínicos según la vía de entrada del virus: cuadro clínico de tipo respiratorio, genital y reproductivo, y con menor frecuencia, sistémico en animales jóvenes. Asimismo, se producen infecciones latentes y los animales pueden estar infectados de por vida sin desarrollar signos clínicos.
En el semental es una enfermedad importante en el control sanitario, porque en caso de reactivación, se producirá la excreción del virus, incluida la vía seminal. Los animales infectados pueden transmitirlo durante toda su vida (Van Oirschot, 1995; Muylkens et al., 2007). Además, el virus también puede ocasionar anomalías cromosómicas y disminuir la tasa de fertilización al unirse a la superficie del espermatozoide. Por esta razón no se aconseja la utilización de sementales infectados. Por su parte, la IBR está incluida en la Lista de Enfermedades de la OIE y en la Directiva Europea que regula el comercio de semen bovino (European Union, 1988, 2004), ya que el virus permanece viable después de su conservación en nitrógeno líquido. La OIE establece una serie de recomendaciones para esta enfermedad respecto al comercio de animales de cría, sementales y semen (http://www.oie.int/eng/normes/mcode/en_sommaire.htm).
En España, este virus está distribuido ampliamente. Se han citado datos de prevalencia de anticuerpos frente al HVB-1 en el 60% de los rebaños y en el 25-40% en individuos (González-García et al., 2009; Yus et al., 2009). Estos datos ponen de manifiesto la importancia de examinar al toro para reducir el riesgo de transmisión de este patógeno.
La IBR es importante, no tanto por las pérdidas económicas directas o indirectas derivadas de la existencia de la enfermedad, actualmente consideradas bastante reducidas, sino por las limitaciones comerciales que resultan de la presencia de la infección en diversas explotaciones o regiones del país.
3.3.2. Etiología
La IBR es una enfermedad producida por el Herpesvirus bovino tipo 1 (HVB1) de la familia Herpesviridae. El virus es antigénicamente estable y sólo hay un serotipo, lo que facilita el control de la infección. Se diferencian dos genotipos, HVB-1.1 y HVB-1.2. Las cepas de HVB-1.1 se han asociado principalmente con el cuadro clínico respiratorio, siendo uno de los agentes del síndrome respiratorio bovino, mientras que las cepas de HVB-1.2 lo han sido con infecciones genitales. Sin embargo, las cepas de los dos genotipos pueden producir tanto la forma respiratoria como genital.
Desde el punto de vista inmunológico y de diagnóstico, y por su papel en las estrategias de control de la enfermedad, las proteínas más importantes del virus son:
– gD: proteína estructural, principal responsable de inducir la producción de anticuerpos neutralizantes.
– gB: proteína estructural necesaria para la replicación vírica.
– gE: proteína estructural, que puede ser deleccionada como sucede en las vacunas marcadas, sin que el virus vea afectada su capacidad inmunogénica.
– tk: proteína no estructural, que confiere al virus afinidad por el sistema nervioso, estando implicada en el establecimiento de infecciones latentes.
3.3.3. Epidemiología
La característica epidemiológica más importante de la enfermedad es que en los animales que se infectan, la infección queda de forma latente (animales portadores), pudiendo reactivarse y produciéndose la excreción del virus a través de las secreciones ocular, nasal y seminal. El virus se difunde con rapidez en las poblaciones receptivas que se ponen en contacto con los animales que han sufrido una reactivación de la infección latente y con los que enferman por primera vez.
Las vías de trasmisión del virus serían las siguientes:
– Forma respiratoria: la transmisión es por contacto directo, indirecto (con agua o alimentos) y por vía aerógena a corta distancia. Las fuentes de infección son, principalmente, los animales enfermos que excretan altas cantidades de virus en secreciones respiratorias y a veces genitales y orales.
– Forma genital: el virus se transmite por vía venérea o mecánica por utilización de material contaminado. Se presenta en los rebaños con monta natural. Los toros pueden ser eliminadores crónicos del virus a través de su semen aun estando clínicamente normales. No obstante, se ha descrito que los toros seropositivos pueden dejar de eliminar virus durante largos periodos de tiempo si se manejan en condiciones no estresantes.
La infección generalmente puede penetrar en un rebaño mediante el ingreso de animales nuevos con infecciones latentes, o a través de aquellos que se han infectado en concursos o ferias y regresan a la explotación. Otro factor de riesgo importante sería el contacto con otros animales como por ejemplo en los pastos comunales.
3.3.4. Patogenia y signos clínicos
Tras la infección se produce la multiplicación del virus en la mucosa de entrada y posteriormente llega a las neuronas sensoriales de los ganglios nerviosos regionales donde puede permanecer en estado latente durante varios años o durante toda la vida del animal. En caso de entrada respiratoria la latencia suele establecerse en el ganglio trigémino y en caso de entrada genital en el ganglio sacro, aunque ocasionalmente también se sitúa en diferentes localizaciones: tonsilas, linfocitos, nódulos linfáticos y bazo. Por alteraciones del sistema inmunitario debido al estrés, tratamiento con corticoides, el parto, transporte o infecciones bacterianas o víricas, la infección latente puede reactivarse con replicación y excreción del virus en las secreciones respiratorias y/o genitales (Figura 14). En el caso del semental el virus también puede eliminarse a través del semen, infectando a las hembras que monte. La replicación vírica en el curso de la reactivación puede originar una recidiva de la enfermedad, si bien en los bovinos la mayoría de las veces cursa de forma subclínica.
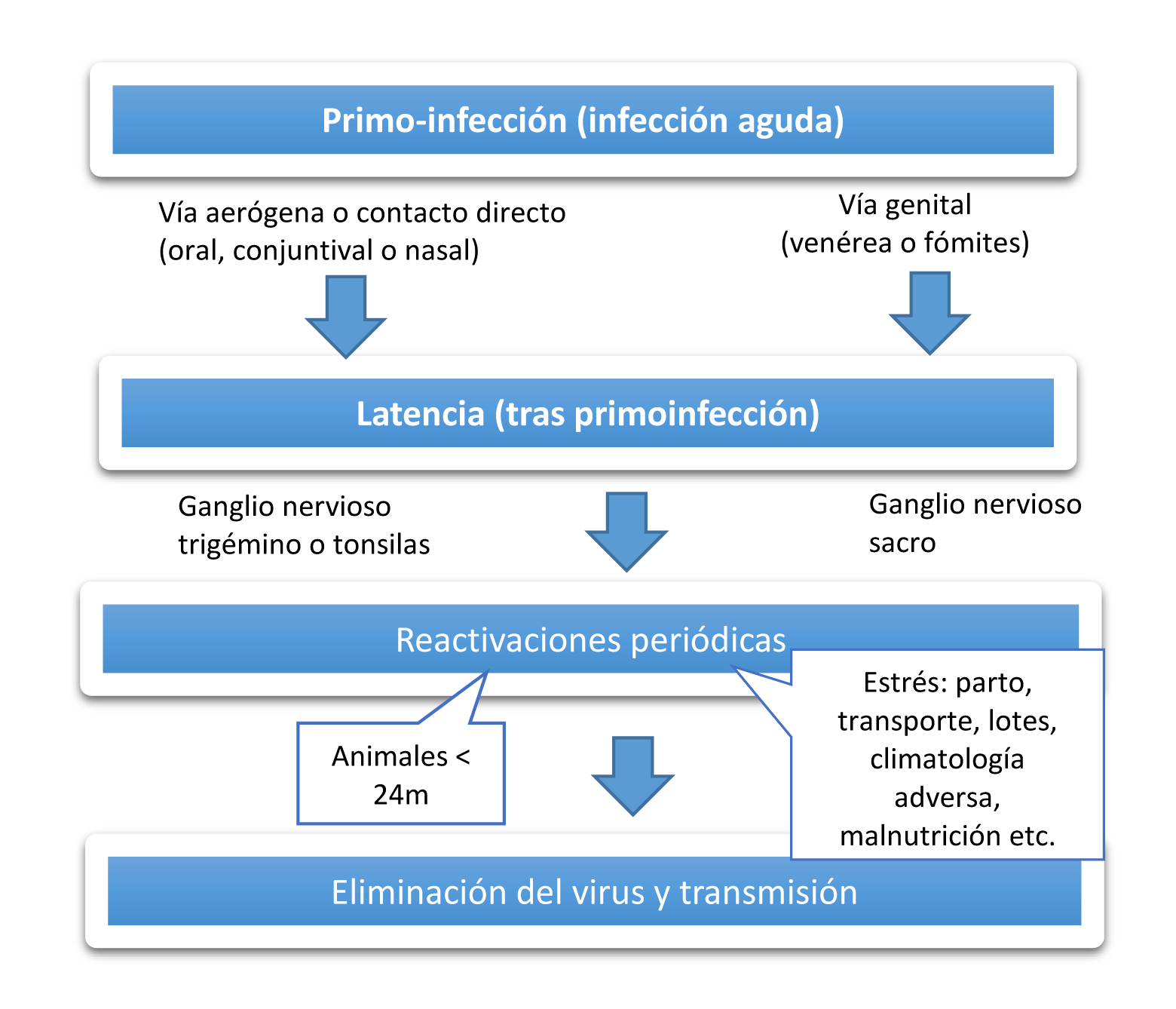
Figura 14. Patogenia de la infección por el virus IBR
En relación al cuadro clínico (Figura 15), se diferencia el cuadro respiratorio (IBR), el genital-reproductivo denominado vulvovaginitis pustular infecciosa (IPV) en la hembra y la balanopostitis infecciosa bovina (IPB) en el macho. Por último, la forma generalizada o sistémica que se presenta en animales recién nacidos, sin anticuerpos frente al virus e infectados con cepas virulentas, siendo una forma poco frecuente y mortal. Se caracteriza por fiebre, abundante, sialorrea, úlceras en mucosas digestivas, diarrea, tos y flujo nasal. En la necropsia se observa la presencia de exudados fibrinosos purulentos y petequias en diferentes mucosas, principalmente en las del sistema respiratorio.
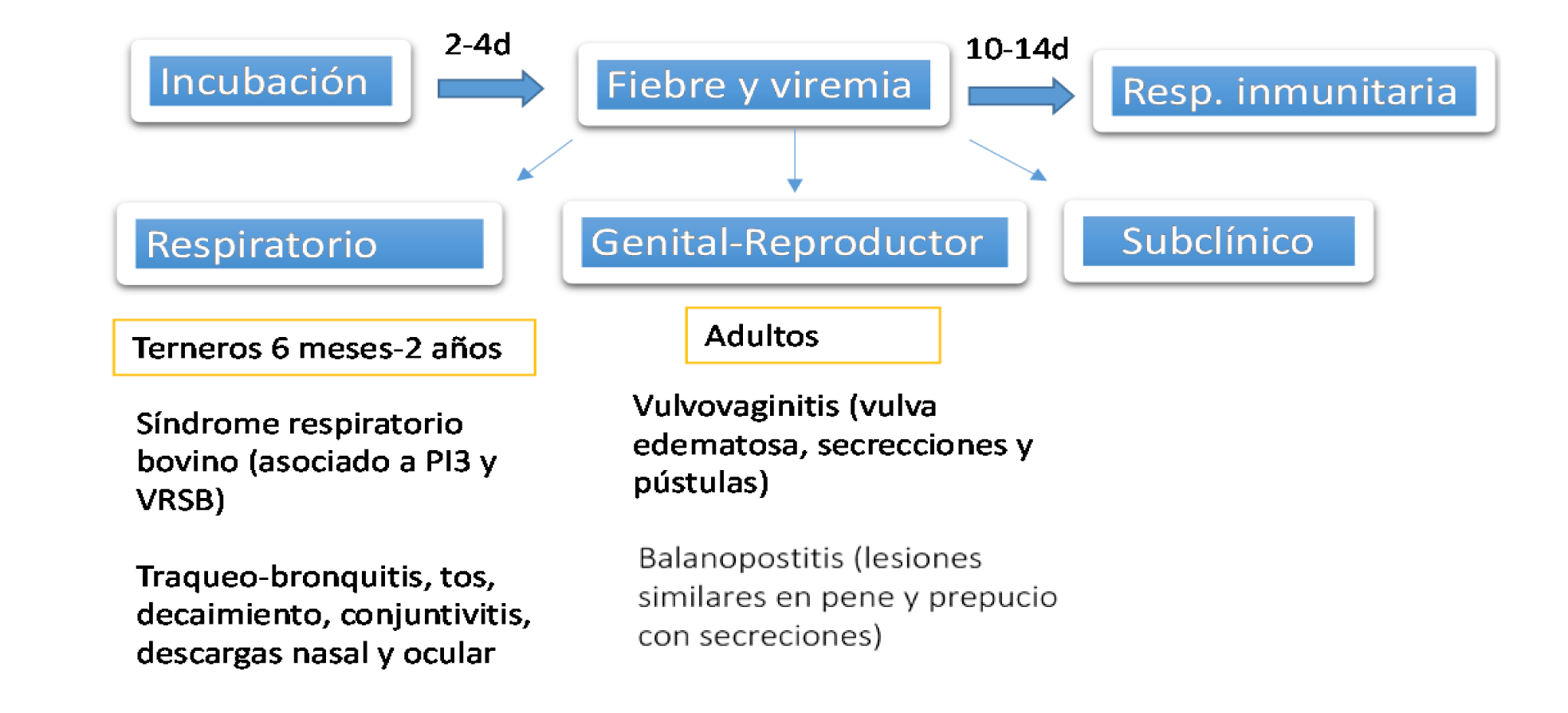
Figura 15. Cuadros clínicos de la IBR
3.3.5. Diagnóstico de laboratorio
El diagnóstico en el semental se realiza normalmente mediante la detección de anticuerpos por técnicas serológicas. Es fundamental conocer si el toro ha sido vacunado, porque en el caso de que se hayan usado vacunas sin marcar, es imposible diferenciar los anticuerpos vacunales de los de la infección.
Recogida de muestras
Se recogerá una muestra de sangre en un tubo sin anticoagulante para la determinación de anticuerpos en suero. Todas estas muestras se enviarán perfectamente identificadas al laboratorio en refrigeración.
Técnicas de laboratorio
Las técnicas de ELISA disponibles para el diagnóstico se describen a continuación:
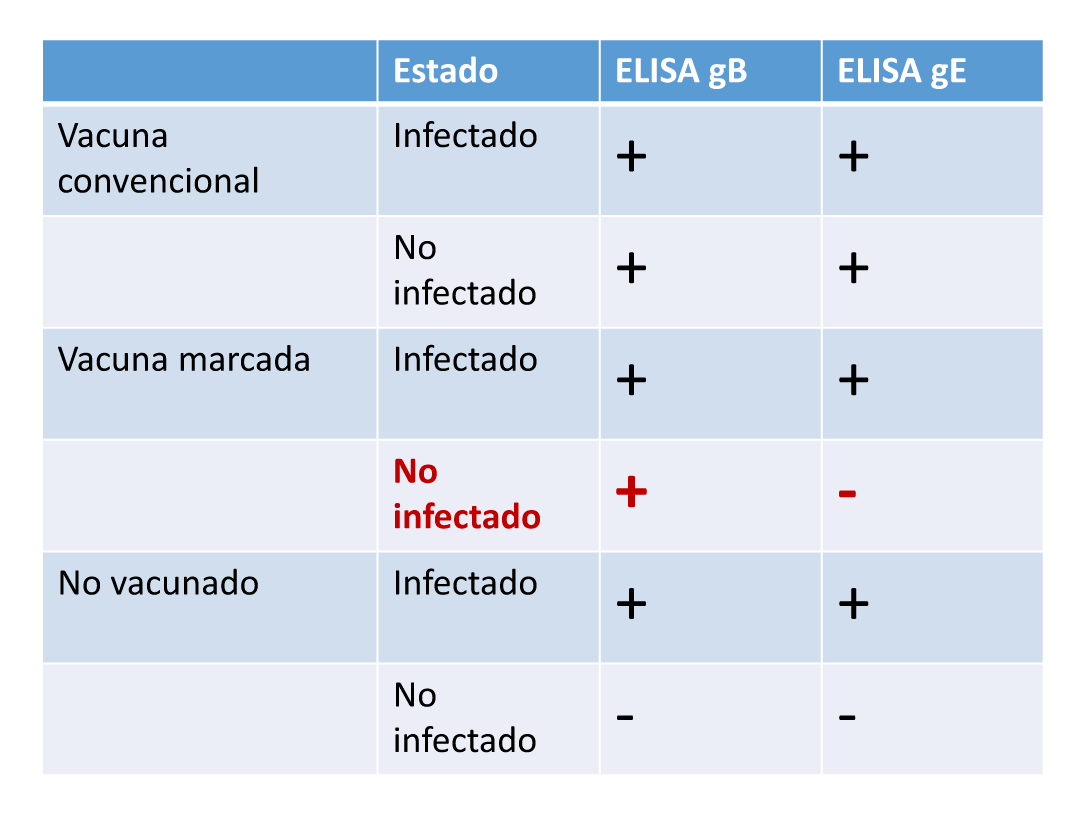
– ELISA-ac totales: es útil para detectar la infección en animales no vacunados.
– ELISA-gB: detecta anticuerpos frente a la glicoproteína gB del HVB1 que es la de mayor intensidad en la respuesta a la infección. Útil para identificar animales no infectados sin vacunar (Ac gB -). En animales Ac gB +, no es posible distinguir si son vacunados o infectados (Tabla 9).
– ELISA-gE: detecta anticuerpos frente a la glicoproteína gE del HVB1. Es la única prueba que permite diferenciar anticuerpos debidos a vacunas marcadas (vacunas DIVA: Differentiating Infected from Vaccinated Animals) en las cuales se encuentra deleccionada la glicoproteína gE del virus, por lo que en los animales vacunados con estas vacunas el resultado debería ser negativo (Tabla 11).
Tabla 11. Interpretación de los resultados de las pruebas ELISA disponibles para el diagnóstico de IBR
El procedimiento de muestreo y el diagnóstico de la forma genital en el macho (IPB) se ha descrito en el apartado 2.1.4.
3.3.6. Control
En España se han publicado recientemente las bases de las actuaciones de prevención, control y erradicación de la IBR y un programa nacional voluntario de lucha frente dicha enfermedad (BOE nº 245, 2019). De forma resumida, las principales actuaciones son las siguientes: por un lado, la calificación sanitaria oficial de las explotaciones en todo el territorio nacional, por otro, la sustitución de las vacunas convencionales por vacunas marcadas, delecionadas de la glicoproteína E, la adhesión voluntaria al Programa de prevención, control y erradicación de IBR y, finalmente, la regulación oficial de los movimientos entre explotaciones según su situación sanitaria.
En líneas generales para el control de la enfermedad en un rebaño, las medidas irán encaminadas a:
– La detección y eliminación progresiva de animales seropositivos de forma voluntaria.
– La vacunación únicamente con vacunas marcadas o la decisión de no vacunar según la prevalencia de la enfermedad en la explotación y los riesgos de transmisión de la misma. Las vacunas marcadas que permiten diferenciar animales vacunados de infectados, y son las únicas que se pueden utilizar. El objetivo de las vacunas es propiciar la inmunidad individual y de rebaño, definida ésta como la disminución de la circulación de virus en un rebaño. Además las vacunas disminuyen la eliminación del virus en el caso de producirse reactivaciones.
– Cumplir medidas de bioseguridad semejantes a las que se señalan en la Figura 16.
En relación a las medidas de bioseguridad, la infección generalmente penetra en un rebaño mediante el ingreso de animales con infecciones latentes, por lo que la mejor medida en un rebaño libre de la infección es mantenerlo cerrado. En caso de introducción de animales, como puede ser el caso de un toro, éstos no deben ser seropositivos ni procedentes de explotaciones donde se usen vacunas convencionales sin marcar, ya que será difícil saber si el animal seropositivo es portador de la infección o simplemente se vacunó. Si no puede garantizarse que los animales provengan de un rebaño libre de la IBR, tienen que analizarse por serología en origen antes de la entrada en el rebaño receptor, someterlos a cuarentena en la explotación de recepción y llevar a cabo un nuevo análisis serológico a las tres semanas, por si los animales hubieran seroconvertido durante el viaje. En todo caso, el semental debe seguir el programa de control y vacunación que se tenga establecido en la explotación.
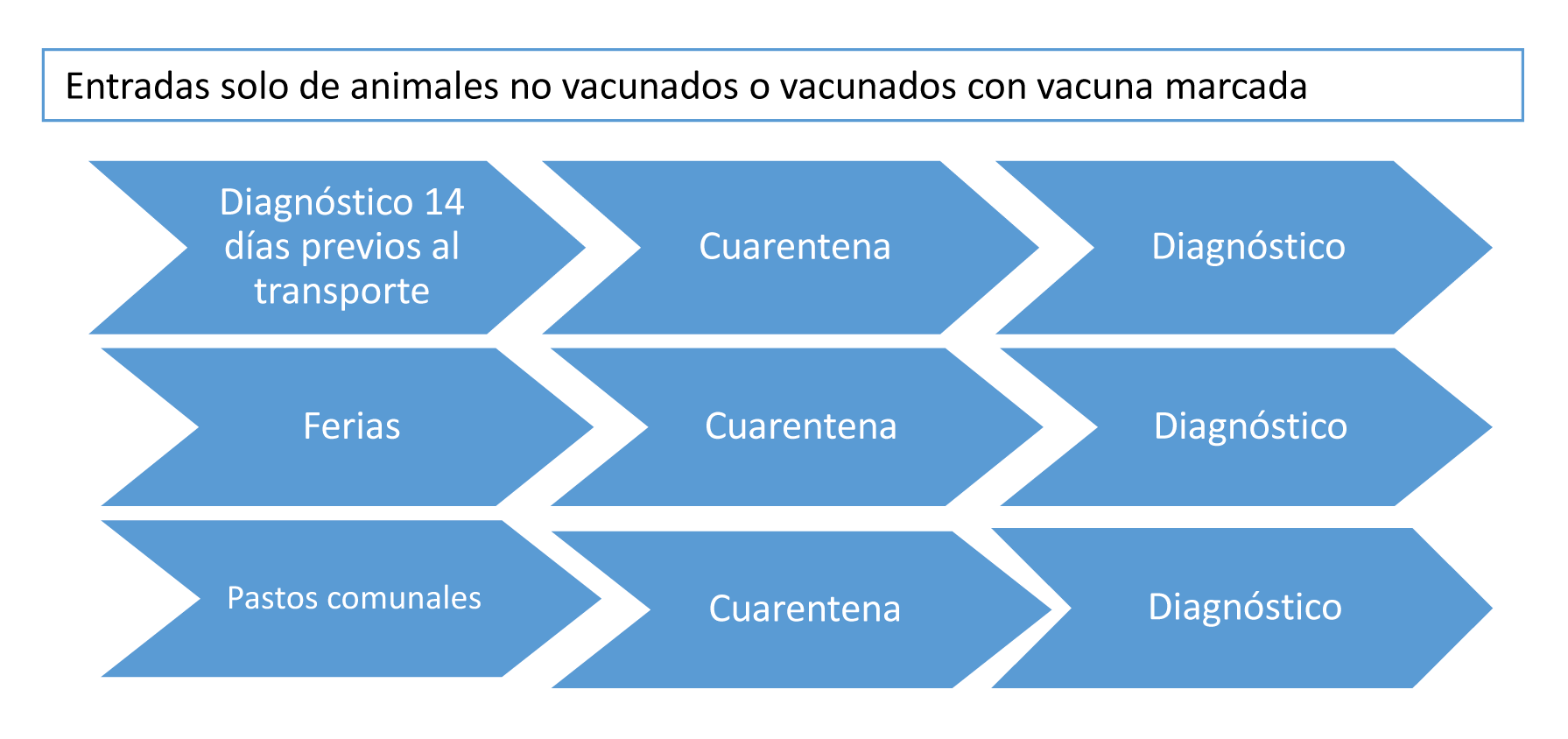
Figura 16. Medidas de bioseguridad para el control de la IBR en relación a las nuevas incorporaciones y movimiento de animales

